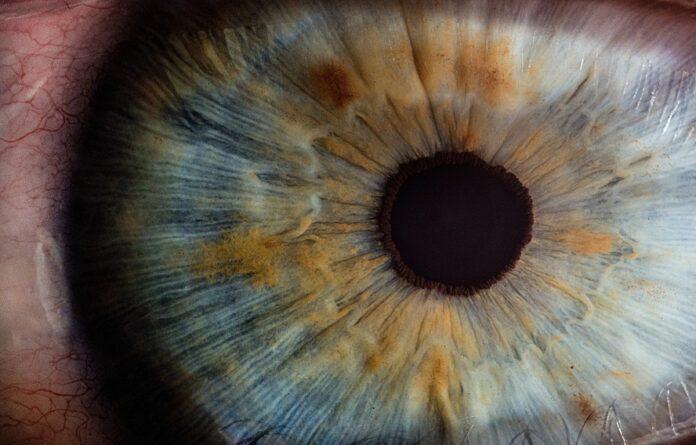
科学家们已经开发出第一个源自患者的白化病干细胞模型。 该模型将有助于研究与眼皮肤白化病 (OCA) 相关的眼部疾病。
S干细胞 是非专业的。 它们在体内不能做任何特定的功能,但它们可以在很长一段时间内进行自我分裂和更新,并有可能变得特化并在体内发育成许多不同的类型,如肌肉细胞、血细胞、脑细胞等。
干细胞存在于我们生命的各个阶段,从胚胎到成年。胚胎干细胞 (ESC) 或胎儿 干细胞 干细胞是在最早的阶段出现的,而作为身体修复系统的成体干细胞则是在成年期出现的。
干细胞可分为四种:胚胎干细胞(ESC)、成体干细胞、癌症干细胞(CSC)和诱导多能干细胞(iPSC)。 胚胎干细胞 (ESCs) 来源于哺乳动物胚胎囊胚阶段的内部质量细胞,这些细胞是 XNUMX 到 XNUMX 天大的。 它们可以无限期地自我更新并分化成所有三个胚层的细胞类型。 另一方面,成体干细胞作为一种修复系统来维持组织中的细胞稳态。 它们可以替代死亡或受伤的细胞,但与 ESC 相比,它们的增殖和分化潜力有限。 癌症干细胞 (CSC) 来自经历基因突变的正常干细胞。 它们引发肿瘤形成一个大的集落或克隆。 癌症干细胞在恶性肿瘤中发挥重要作用,因此靶向它们可以提供治疗癌症的方法。
诱导多能干细胞 (iPSC) 来源于成体体细胞。 它们的多能性是在实验室中通过基因和其他因素对体细胞进行重编程人工诱导的。 iPSCs 在增殖和分化方面就像胚胎干细胞。 第一个 iPSC 是 Yamanaka 于 2006 年从鼠成纤维细胞中开发出来的。从那时起,已经从患者特异性样本中开发了几种人类 iPSC。 由于患者的遗传学反映在 iPSC 的遗传学中,因此这些重新编程的体细胞被用于模拟遗传疾病,并彻底改变了人类遗传疾病的研究。
模型是显示在实际疾病中观察到的全部或部分病理过程的动物或细胞。 实验模型的可用性对于在细胞和分子水平上理解疾病的发展很重要,这有助于开发治疗方法。 模型有助于了解疾病如何发展和测试潜在的治疗方法。 例如,人们可以在模型的帮助下确定有效的药物靶点,或者筛选可以降低严重程度并阻止疾病进展的小分子。 动物模型早已被使用,但有几个缺点。 此外,由于遗传差异,动物模型不适合遗传疾病。 现在,人类干细胞(胚胎干细胞和诱导多能干细胞)越来越多地用于模拟人类疾病。
使用人类 iPSC 的疾病建模已经成功地完成了几个 条件 如侧索硬化症、血液疾病、糖尿病、亨廷顿病、脊髓性肌萎缩症等。 人类 iPSC 模型 人类神经疾病、先天性心脏病和其他遗传疾病。
然而,直到 11 年 2022 月 XNUMX 日,作为美国国立卫生研究院 (NIH) 一部分的美国国家眼科研究所 (NEI) 的科学家们报告开发了一种基于人类 iPSC 的白化病体外模型时,人类白化病 iPSC 模型才可用。眼皮肤白化病 (OCA)
眼皮肤白化病 (OCA) 是一种遗传性疾病,会影响眼睛、皮肤和头发的色素沉着。 患者患有眼部问题,例如最佳矫正视力降低、眼部色素沉着减少、中央凹发育异常和/或视神经纤维异常交叉。 人们认为改善眼睛色素沉着可以预防或挽救一些视力缺陷。
研究人员开发了一种用于研究人类视网膜色素上皮 (RPE) 色素沉着缺陷的体外模型,并表明体外来源于患者的视网膜色素上皮组织重现了白化病中的色素沉着缺陷。 这是非常有趣的,因为白化病的动物模型不适合,并且用于研究黑色素生成和色素沉着缺陷的人类细胞系有限。 本研究中开发的源自患者的 OCA1A-和 OCA2-iPSC 可以成为可再生和可重复的细胞来源,用于生产靶细胞和/或组织类型。 体外衍生的 OCA 组织和 OCA-iRPE 将有助于更深入地了解黑色素的形成过程,并识别与色素沉着缺陷有关的分子,并进一步探索分子和/或生理差异。
这是朝着治疗眼皮肤白化病 (OCA) 相关疾病目标迈出的非常重要的一步。
***
参考文献:
- Avior, Y., Sagi, I. & Benvenisty, N. 多能干细胞在疾病建模和药物发现中的应用。 Nat Rev Mol 细胞生物学 17, 170–182 (2016)。 https://doi.org/10.1038/nrm.2015.27
- Chamberlain S.,2016。使用人类 iPSC 进行疾病建模。 人类分子遗传学,第 25 卷,第 R2 期,1 年 2016 月 173 日,第 R181-RXNUMX 页, https://doi.org/10.1093/hmg/ddw209
- Bai X.,2020。基于干细胞的疾病建模和细胞治疗。 细胞 2020, 9(10), 2193; https://doi.org/10.3390/cells9102193
- 乔治A., 等 2022. 使用人类诱导的多能干细胞衍生的视网膜色素上皮细胞对 I 型和 II 型眼皮肤白化病进行体外疾病建模(2022 年)。 干细胞报告。 第 17 卷,第 1 期,P173-186,11 年 2022 月 XNUMX 日 DOI: https://doi.org/10.1016/j.stemcr.2021.11.016
***